Как сделать укол кошке в домашних условиях. Какие бывают виды инъекций для кошек. Как подготовиться к процедуре. Пошаговая инструкция по выполнению подкожных, внутримышечных и внутривенных уколов кошке. Возможные осложнения при неправильном выполнении инъекций.
Содержание
Подготовка к проведению инъекции кошке
Перед тем как делать укол кошке, необходимо тщательно подготовиться к процедуре. Это поможет провести инъекцию максимально быстро и безопасно для питомца. Рассмотрим основные этапы подготовки:
Выбор места для проведения процедуры
Для выполнения укола лучше выбрать тихое, хорошо освещенное помещение, где кошку ничто не будет отвлекать. Подготовьте удобный стол или другую ровную поверхность, застелите ее полотенцем или пеленкой, чтобы животное не скользило.
Подготовка необходимых инструментов
Для инъекции вам понадобятся:
- Стерильный шприц подходящего объема
- Игла нужного диаметра и длины
- Лекарственный препарат
- Ватные диски
- Антисептик для обработки кожи
- Одноразовые перчатки
Все инструменты должны быть стерильными. Разместите их на чистой поверхности в удобном для вас порядке.
Подготовка лекарственного препарата
Внимательно изучите инструкцию к препарату. Обратите внимание на следующие моменты:
- Способ введения (подкожно, внутримышечно, внутривенно)
- Дозировка для кошки с учетом ее веса
- Необходимость разведения препарата
- Условия и срок хранения
Если препарат хранился в холодильнике, дайте ему нагреться до комнатной температуры. Холодный раствор может вызвать болезненные ощущения у кошки.
Подготовка животного
Постарайтесь успокоить кошку перед процедурой. Лучше всего делать укол после сна, когда питомец расслаблен. Если животное беспокойное, можно попросить кого-то из домашних помочь с фиксацией. Некоторые владельцы используют специальные фиксаторы или оборачивают кошку полотенцем, оставляя свободной только нужную часть тела.
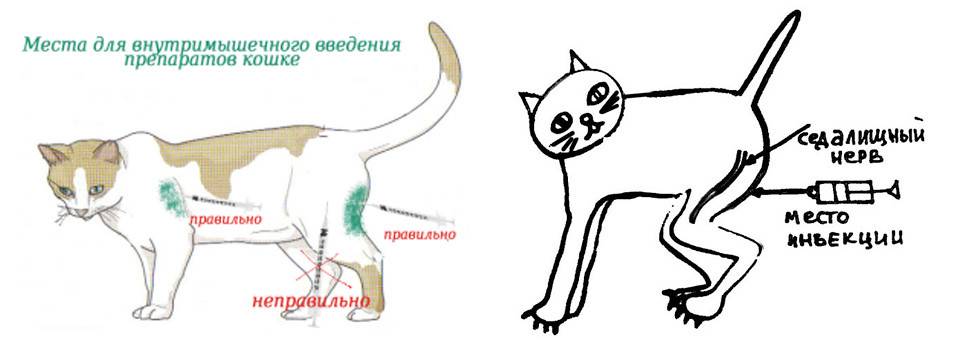
Техника выполнения различных видов инъекций кошке
Существует три основных вида инъекций для кошек: подкожные, внутримышечные и внутривенные. Рассмотрим технику выполнения каждого из них.
Подкожная инъекция
Это наиболее простой и безопасный вид укола, который часто назначают для домашнего выполнения.
Техника выполнения:
- Соберите кожу в складку в области холки.
- Введите иглу под углом 45 градусов в основание складки.
- Слегка оттяните поршень, чтобы убедиться, что игла не попала в сосуд.
- Медленно введите препарат.
- Извлеките иглу и слегка помассируйте место укола.
Внутримышечная инъекция
Такие уколы обычно делают в мышцы бедра. Они более болезненны для животного, поэтому требуют надежной фиксации.
Техника выполнения:
- Уложите кошку на бок, зафиксировав лапы.
- Нащупайте мышцу бедра.
- Введите иглу быстрым движением перпендикулярно коже на глубину 1-1,5 см.
- Проверьте, не попали ли в сосуд, слегка оттянув поршень.
- Медленно введите препарат.
- Извлеките иглу и помассируйте место укола.
Внутривенная инъекция
Это наиболее сложный вид инъекций, который рекомендуется выполнять только ветеринарному врачу. Обычно препарат вводят в вену на передней лапе.
Техника выполнения:
- Надежно зафиксируйте кошку.
- Сбрейте шерсть в месте укола.
- Наложите жгут для лучшей визуализации вены.
- Продезинфицируйте кожу.
- Введите иглу в вену под небольшим углом.
- Убедитесь, что игла в вене — в шприц должна поступить кровь.
- Медленно введите препарат.
- Извлеките иглу, прижав место укола ватным тампоном.
Возможные осложнения при неправильном выполнении инъекций
При несоблюдении техники выполнения укола у кошки могут возникнуть следующие осложнения:
- Гематома или кровотечение в месте укола
- Абсцесс из-за занесения инфекции
- Повреждение нерва, приводящее к хромоте
- Аллергическая реакция на препарат
- Некроз тканей при попадании раздражающего препарата под кожу
При появлении любых тревожных симптомов после укола следует немедленно обратиться к ветеринару.
Заключение
Выполнение инъекций кошке в домашних условиях — ответственная процедура, требующая определенных навыков. Если у вас нет опыта, лучше доверить это ветеринарному специалисту. При необходимости самостоятельного выполнения уколов, тщательно изучите технику и проконсультируйтесь с врачом. Правильно выполненная инъекция поможет вашему питомцу быстрее выздороветь и избежать осложнений.
Как сделать внутримышечный укол коту
Содержание статьи:
Кошки – самодостаточные и независимые животные, чувствующие себя комфортно только на своей территории. Любой выход из своей «зоны комфорта» для животного стресс, провоцирующий серьезный дисбаланс во всем организме.
Поэтому бывает крайне важно научиться делать внутримышечные уколы животному самостоятельно, чтобы не подвергать его лишнему стрессу при посещении ветеринарной клиники.
Зачем владельцу уметь делать уколы
Посещение ветеринарной клиники не всегда удобно для владельца. Зная последовательность и правила проведения внутримышечной инъекции, владелец сможет самостоятельно при необходимости оказать своему любимцу помощь. Научиться делать укол коту может даже тот, кто далек от медицины в целом.
Внутримышечная инъекция позволяет направить лекарственное средство сразу в мышцу.
У котов подходящим местом для укола является область бедра. Именно в этом месте проходит большое количество крупных сосудов. Через них лекарственное средство быстро абсорбируется и проникнет в системный кровоток через 5-8 минут.
Несомненным плюсом умения правильного проведения процедуры своему животному является избавление от проблем с образованием уплотнений. Образование инфильтратов чаще наблюдается при подкожном введении лекарственных препаратов.
Внутримышечный укол позволяет таким препаратам как нейролептики или антибиотики, поступать в организм дозировано через сосуды с правильной концентрацией и поддержанием ее в теле животного. При использовании таблетированных сильнодействующих антибиотиков, нарушение работы пищеварительного тракта наблюдается чаще. Внутримышечную инъекцию можно делать не только взрослым животным, но и маленьким котятам. Важно правильно подготовиться к процедуре и подготовить само животное.
Следует понимать, что процедура будет доставлять дискомфорт животному. Но чем качественнее будет проводиться инъекция с соблюдением всех правил, тем меньше рисков развития осложнений. Так, например, при больших количествах вводимых препаратов, происходит травматизация тканей и расслаивание мышечных волокон.
Но чем качественнее будет проводиться инъекция с соблюдением всех правил, тем меньше рисков развития осложнений. Так, например, при больших количествах вводимых препаратов, происходит травматизация тканей и расслаивание мышечных волокон.
Техника внутримышечного укола коту
Первое проведение процедуры – волнительное событие, как для владельца, так и для самого животного.
У опытных хозяев, неоднократно делавшим своим питомца инъекции, манипуляция занимает мало времени и практически не чувствуется самим животным. Следует запомнить технику проведения, основывающуюся на двух компонентах – подготовка и алгоритм введения.
Подготовка подразумевает под собой определение места прокола и успокоение животного. Подбирать место последующей инъекции необходимо так, чтобы на нем не было травм и воспалений. Длинный шерстный покров следует удалить, состричь ножницами.
Основными этапами подготовки являются:
- Выкладывание на чистую поверхность шприца, ампулы с лекарственным препаратом, спирта и ваты.

- Внимательное изучение инструкции к препарату непосредственно перед тем, как набирать его в шприц. Если возникли вопросы, лучше перезвонить лечащему ветеринарному врачу.
- Тщательно вымыть руки с мылом под проточной водой и продезинфицировать их спиртом.
- Набрать лекарство в шприц и затем удалить весь лишний воздух. Для этого поршень шприца медленно двигают вперед, чтобы заполнить пустоты жидкостью.
- Место инъекции нет необходимости предварительно протирать спиртовым раствором, так как это только нарушит защитный слой.
После выполнения всех правил подготовки, можно приступать к введению лекарственного средства. Хорошо, если кто-то из домашних будет помогать в момент проведения процедуры. Тогда манипуляция пройдет для животного менее стрессово.
Алгоритм правильного введения следующий:
- Животное укладывают на бок и придерживают за конечности. Можно воспользоваться фиксатором или прищепкой.
 Помещенная на холку прищепка, будет создавать у животного чувство, что его держат и не станет сдвигаться с места.
Помещенная на холку прищепка, будет создавать у животного чувство, что его держат и не станет сдвигаться с места. - Далее следует тщательно нащупать кость, чтобы предотвратить возможность упора иглы в это место.
- Выбранную область для инъекции не следует сжимать.
- Во время проведения манипуляции после введения иглы, необходимо немного оттянуть поршень, для того чтобы посмотреть нет ли в шприце крови. Это связано с тем, что ряд препаратов не должен попадать сразу в крупные сосуды. Если все нормально и крови в шприце нет, начинают вводить лекарственный препарат. При наличии крови в шприце, иглу вытягивают и делают прокол в другом месте.
- Введение иглы должно проводиться под углом в 45 градусов. Взрослым животным иглу следует вводить в среднюю часть бедра не более чем на 10 мм. Котятам вводят иглу на еще меньшую длину.
- Препарат вводят не менее 2-3 секунд, а в некоторых случаях дольше. Скорость введения препарата зависит и от его количества.

- Вытаскивают иглу под тем же углом, что и вводилась.
После манипуляции протирать место укола нет необходимости. Животное нужно погладить, ласкового поговорить и дать угощение. Потом отпустить и не настаивать на внимание.
Первая инъекция даже в домашних условиях, все равно будет стрессом для кошки.
Сервис онлайн диагностики болезней кошек >
Уход, содержание и лечение Вашего питомца
4 пункта профилактики стоматита у кошек
Хозяин кошки должен внимательно следить за здоровьем питомца. С целью предотвращения развития…
Где кошка может заразиться гемобартонеллезом
Специалисты выделяют 5 основных путей заражения кошки гемобартонеллезом. Каждый владелец домашнего…
4 распространенных эндокринных заболевания у кошек
Эндокринные заболевания у домашних питомцев ветеринары диагностируют в последнее время все…
Черные точки на хвосте у кошки
Черные точки на коже могут появляться и у домашних питомцев. Локализация камедонов преимущественно…
Локализация камедонов преимущественно…
Если подобрали котенка с улицы — чек лист
Уличному котенку необходимо обеспечить правильный уход. Особенно, это касается питания и здоровья.…
3 причины аллергического дерматита у кошек
Одна из диагностируемых патологий у кошек – аллергический дерматит. Причиной выступает аллергическая…
5 путей заражения кошки гемобартонеллезом
В результате активности патогена, происходят серьезные изменения, вплоть до тяжелых осложнений…
4 симптома листериоза у кошек
Важно знать, как проявляется листериоз у домашнего питомца, чтобы иметь возможность оказать…
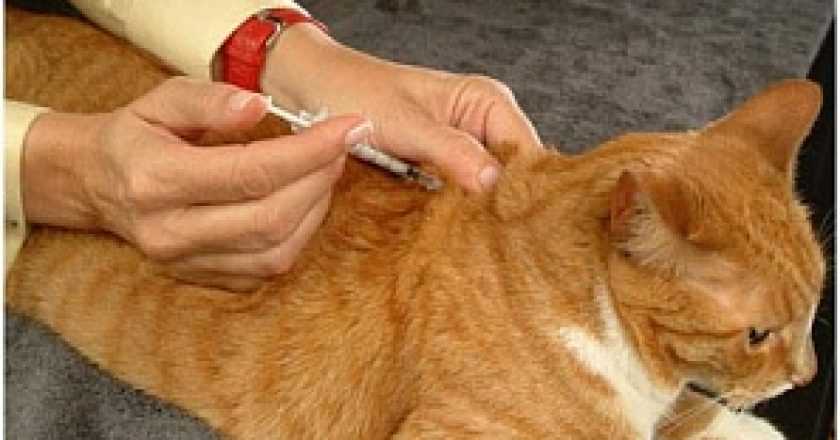
Как сделать укол кошке правильно в холку или мышцу
25 октября 2022
Даже при должной заботе о здоровье питомца случаются ситуации, когда без помощи инъекций не обойтись. Провести процедуру на 100% безопасно может только специалист, но иногда возможности посетить клинику нет. В таком случае хозяин должен обладать необходимыми знаниями, чтобы справиться с задачей самостоятельно. Как сделать укол кошке, какие бывают виды инъекций и как подготовиться к процедуре — рассказываем в этой статье.
Провести процедуру на 100% безопасно может только специалист, но иногда возможности посетить клинику нет. В таком случае хозяин должен обладать необходимыми знаниями, чтобы справиться с задачей самостоятельно. Как сделать укол кошке, какие бывают виды инъекций и как подготовиться к процедуре — рассказываем в этой статье.
Алёна Баженова
Содержание
Подготовка к процедуре
Выбираем шприц для инъекции
Пошаговая инструкция
Последствия неправильных действий
Подготовка к процедуре
Прежде чем приступить, необходимо тщательно подготовить место, инструменты и самого питомца.
Выберите место
Делать укол лучше в тихом месте, где питомца не будут отвлекать другие животные или громкие звуки. Расположите стол в хорошо освещенной комнате и уберите с него лишние предметы. Постелите полотенце или пеленку: во время процедуры кошка не должна скользить по поверхности, особенно если во время укола она находится в стоячем или сидячем положении.
Подготовьте препарат
Тщательно изучите рекомендации производителя и сверьтесь с рецептом из клиники. В инструкции указан способ введения препарата: внутримышечно, подкожно или внутривенно. Вводить лекарственное средство необходимо только в соответствии с инструкцией, чтобы избежать осложнений.
Также учтите, что условия хранения у разных препаратов могут отличаться по температуре и доступу света. Если препарат хранился некорректно, использовать его не стоит: он может не только не оказать должного эффекта, но и нанести вред здоровью питомца. Те же правила касаются срока годности. Использовать средство с истекшим сроком запрещено.
- Если препарат хранился в холодильнике, разогрейте его до комнатной температуры: для этого подержите шприц со средством в ладонях. Введение холодного вещества доставит питомцу дискомфорт и может вызвать воспаление;
- Препарат в стеклянных ампулах необходимо заранее надпилить и аккуратно открыть по линии спила непосредственно перед забором жидкости.
 Пилочка, как правило, идет в комплекте;
Пилочка, как правило, идет в комплекте; - Препарат с резиновой крышкой не требует вскрытия: в центр крышки вводится игла, которая перед введением лекарственного средства меняется на новую;
- Препарат в порошковой форме следует развести физраствором или другой жидкостью, идущей в комплекте. Пропорции и способ разведения можно найти в инструкции по применению;
- Если одна ампула лекарственного средства рассчитана на несколько процедур, необходимо распределить препарат по шприцам и хранить согласно рекомендациям производителя.
Четко следуйте инструкции по применению и проконсультируйтесь с ветеринарным врачом, если в ходе подготовки препарата что-то вас смутило или пошло не так. Правильная подготовка позволит достигнуть максимального эффекта от процедуры и избавит от многих побочных эффектов.
Подготовьте инструменты
Для проведения процедуры вам понадобятся стерильные шприцы — индивидуальные для каждого препарата, лекарственное средство, дезинфектор, вата и пилочка для вскрытия ампул. Всех инструментов необходимо касаться чистыми руками, поэтому перед началом процедуры вымойте и продезинфицируйте руки.
Всех инструментов необходимо касаться чистыми руками, поэтому перед началом процедуры вымойте и продезинфицируйте руки.
Инструменты должны находиться у вас под рукой, но на достаточном расстоянии от питомца: если кошка начнет вырываться, она может скинуть их на пол, и тогда готовиться к процедуре придется заново.
Подготовьте кошку к процедуре
Питомец всегда чувствует нервное напряжение, поэтому хозяин должен действовать уверенно и спокойно. Лучше делать укол сразу после сна, когда питомец расслаблен и не сопротивляется.
Возможно, потребуется дополнительная фиксация животного. Для этого лучше задействовать другого человека, чтобы вы могли точно попасть в место укола и не навредить животному. Можно дополнительно зафиксировать питомца при помощи полотенца, освободив нужную конечность.
Выбираем шприц для инъекции
Выбор шприца зависит от количества и плотности препарата, который необходимо ввести, и размера животного. Объем шприца, длина и диаметр иглы должны быть такими, чтобы процедура прошла как можно быстрее, и питомец не испытал сильный стресс.
Объем шприца
Для большинства инъекций подходят шприцы объемом 2-3 мл. Инсулиновые шприцы на 1 мл использовать тоже можно, но с особой осторожностью: их иглы очень тонкие и короткие, в связи с чем лекарственный препарат может не достигнуть места назначения и вызвать воспаление тканей. Также игла инсулинового шприца может сломаться, если питомец начнет вырываться.
Если объем препарата превышает 2-3 мл, используют шприцы на 5, 10 или 20 мл в зависимости от объема вводимого вещества.
Диаметр иглы
Диаметр иглы зависит от «вязкости» лекарственного средства. Если препарат плотный или густой, диаметр должен быть минимум 0,7 мм, чтобы препарат быстрее проходил через иглу. Учтите, чем тоньше игла, тем больше придется прикладывать усилий для введения средства, что значительно снизит скорость проведения процедуры. Поэтому для плотных и тягучих лекарств лучше использовать иглы от шприцов на 5-10 мл, для инъекций котятам – от шприцов на 2-3 мл.
Для препаратов на водной основе подойдет игла диаметром до 0,6 мм и длиной до 30 мм. Если необходимо сделать инъекцию котенку, возьмите иглу от инсулинового шприца. Взрослым питомцам подойдет игла от шприца 2-3 мл.
Если необходимо сделать инъекцию котенку, возьмите иглу от инсулинового шприца. Взрослым питомцам подойдет игла от шприца 2-3 мл.
Цена деления
Также необходимо понимать, какому объему жидкости соответствует деление на шприце.
- В шприце на 1 мл большие деления равны 0,1 мл, а маленькие – 0,01 мл;
- В шприце на 2 мл большие деления равны 1 мл, маленькие – 0,1 мл;
- В шприце на 5 мл большие деления равны 1 мл, маленькие – 0,2 мл.
Необходимо точно рассчитать цену деления, чтобы не допустить ошибку в дозировке средства. Если вы сомневаетесь в том, что верно определили дозировку, проконсультируйтесь с ветеринарным врачом.
Пошаговая инструкция
Если вы не имели опыта в проведении подобных процедур, необходимо, чтобы ветеринарный врач наглядно продемонстрировал, как правильно делать укол животному. Так питомец получит меньше неприятных ощущений, а риск развития осложнений будет минимальным.
Проведите мероприятия по подготовке к процедуре и выполняйте следующие шаги:
- Тщательно вымойте и продезинфицируйте руки;
- Установите иглу на шприц и снимите защитный колпачок.
 Не касайтесь стерильной иглы руками;
Не касайтесь стерильной иглы руками; - Наберите препарат в шприц согласно прописанной дозировке;
- Избавьтесь от воздуха: постучите по цилиндру ногтем и подвигайте поршнем вверх-вниз, пока не выйдут все пузырьки. Если воздух попадет в кожу или мышцу, он рассосется сам, но вызовет болезненные ощущения у питомца. Попадание воздуха в вену крайне опасно для здоровья животного и может привести к необратимым последствиям;
- Зафиксируйте питомца;
- Аккуратно введите иглу;
- Плавно потяните поршень на себя, чтобы проверить, не задеты ли капилляры. Если жидкость в шприце окрасилась в красный цвет, необходимо извлечь иглу и сделать укол повторно;
- Когда вы убедитесь, что ввели иглу верно, плавно нажмите на поршень, чтобы ввести препарат;
- Выньте иглу. Обрабатывать место укола не требуется;
- Похвалите питомца и поощрите лакомством.
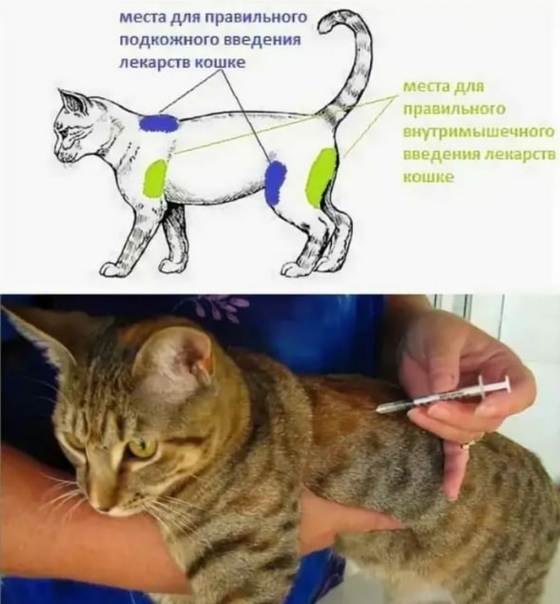
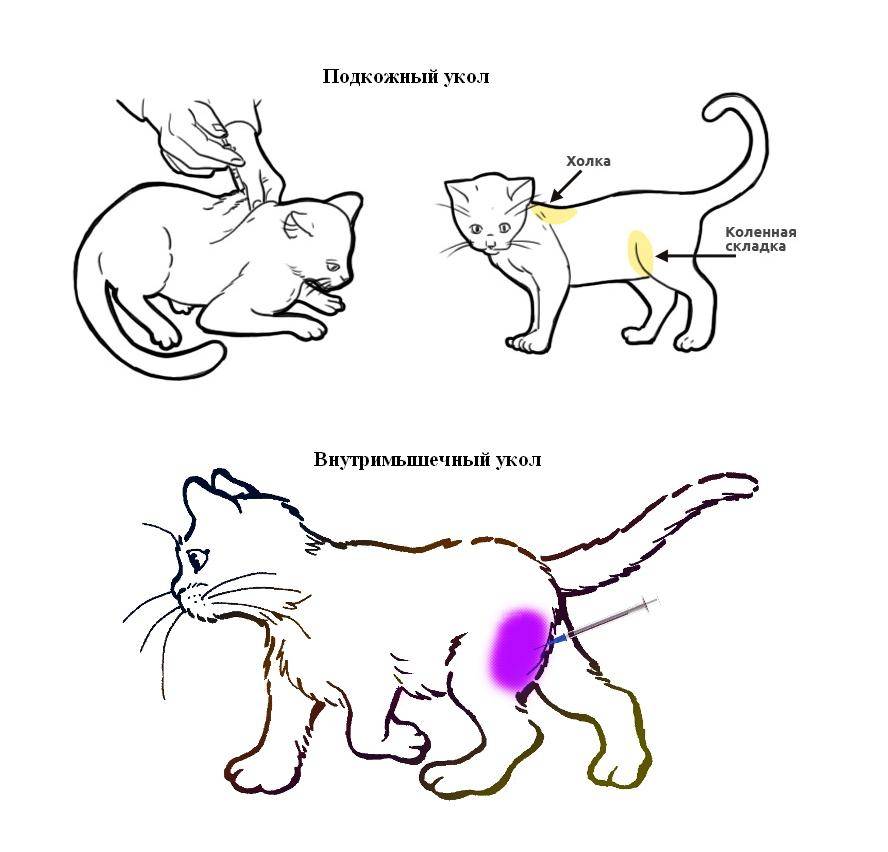
Укол подкожный или в холку
Подкожный укол можно делать в холку, паховую складку или переднюю поверхность бедра.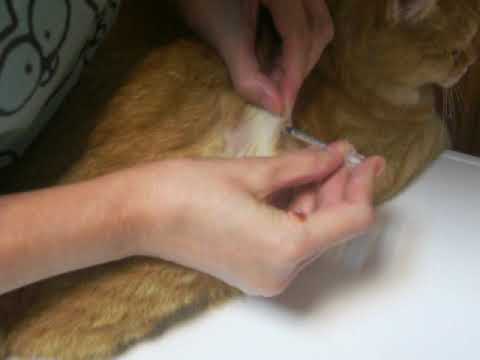 Чаще инъекцию делают в область холки.
Чаще инъекцию делают в область холки.
Холка – это место соединения спины и шеи чуть выше лопаток. Кожа на холке легко собирается в складку, образуя «карман», куда необходимо делать инъекцию. Это место обладает небольшим количеством нервных окончаний, поэтому укол получается менее болезненным, а строение подкожной ткани позволяет вводить большие объемы растворов.
Чтобы сделать подкожный укол, следуйте инструкции:
- Соберите кожу, немного оттянув ее вверх, и введите иглу в складку в направлении от головы. Шприц необходимо держать, как дротик, чтобы не задеть поршень. Если вы случайно заденете поршень, препарат останется в верхних слоях кожи, что может привести к развитию воспаления;
- Аккуратно введите иглу. Кожа в области холки достаточно толстая, поэтому вы можете ощутить небольшое сопротивление. Когда вы почувствуете, что сопротивление ослабло, проверьте, не задеты ли капилляры. Если шприц наполнился кровью, необходимо достать иглу и сделать укол повторно;
- Плавно нажмите на поршень и введите препарат.
 Следите, чтобы игла не проткнула кожу насквозь;
Следите, чтобы игла не проткнула кожу насквозь; - Если объем шприца не позволяет сделать укол за один раз, оставьте иглу в холке и наполните шприц заново;
- Достаньте иглу, расправьте складку и помассируйте ее пальцем;
- Поощряйте питомца лаской и угощением.
Процедура занимает от 3 до 5 секунд и не приносит питомцу болевых ощущений при соблюдении техники.
Укол внутримышечный
Внутримышечная инъекция, как правило, делается в заднюю поверхность бедра – место между коленным и тазобедренным суставами. Этот участок тела пронизан кровеносными сосудами, что позволяет препарату быстро проникать в кровь. По сравнению с подкожным уколом, этот вид инъекций является более болезненным для питомца, поэтому вам точно потребуется помощь для фиксации животного.
Чтобы сделать внутримышечный укол, выполняйте следующие шаги:
- Положите питомца на бок и зафиксируйте его, удерживая все четыре конечности и холку;
- Помассируйте бедро, чтобы расслабить мышцы;
- Прощупайте место инъекции, чтобы случайно не попасть в сустав.
 Чтобы правильно определить место укола, найдите бедренную кость и отступите расстояние, равное длине большого пальца;
Чтобы правильно определить место укола, найдите бедренную кость и отступите расстояние, равное длине большого пальца; - Введите иглу под прямым углом не более, чем на 1 см. Если питомец сопротивляется, успокойте его и продолжайте вводить иглу, не раскачивая ее из стороны в сторону и не прокручивая шприц вокруг своей оси;
- Потяните поршень на себя, чтобы проверить, не задеты ли капилляры;
- Медленно нажмите на поршень и введите средство. Необходимо вводить препарат настолько медленно, насколько позволяет терпение питомца. Если кошка начинает вырываться, можно ввести препарат быстрее, чтобы избежать травмы седалищного нерва от резких движений;
- Извлеките иглу и поощрите питомца.
Правильно сделанные внутримышечные уколы доставляют дискомфорт питомцу только во время проведения процедуры. Если необходимо сделать курс уколов, чередуйте левую и правую конечности, чтобы мышечная ткань успевала восстановиться.
Внутривенная инъекция
Преимуществом внутривенных инъекций является скорость действия лекарственного препарата. После проведения процедуры эффект заметен, как правило, через несколько часов в зависимости от вводимого вещества.
После проведения процедуры эффект заметен, как правило, через несколько часов в зависимости от вводимого вещества.
Внутривенные уколы требуют особых навыков, поэтому делать такие инъекции самостоятельно не рекомендуется. Только ветеринарный врач может правильно определить место укола и выполнить процедуру без вреда для здоровья животного.
Последствия неправильных действий
При несоблюдении техники у питомца могут возникнуть осложнения:
- Гематомы или кровотечения. Если во время процедуры игла задевает кровеносные сосуды, в месте укола может проступить кровь. Приложите лед, чтобы уменьшить болевые ощущения и остановить кровотечение. Если кровь не останавливается, обратитесь к ветеринарному врачу;
- Хромота. Болезненные ощущения от введения препарата или повреждение седалищного нерва иглой могут вызвать хромоту. Питомец должен прийти в норму в течение часа, но если в течение двух дней хромота сохраняется, обратитесь в ветеринарную клинику за помощью;
- Инфильтрат (шишка).
 Появление уплотнений свидетельствует о том, что препарат не рассосался или что рана от укола не заживает. Шишки, как правило, появляются от введения препаратов на масляной основе или больших объемов лекарственного средства. Наблюдайте за питомцем в течение 1-2 дней: если уплотнение не рассасывается, питомца необходимо показать специалисту;
Появление уплотнений свидетельствует о том, что препарат не рассосался или что рана от укола не заживает. Шишки, как правило, появляются от введения препаратов на масляной основе или больших объемов лекарственного средства. Наблюдайте за питомцем в течение 1-2 дней: если уплотнение не рассасывается, питомца необходимо показать специалисту; - Абсцесс – гнойное образование в месте укола – может возникнуть при инфицировании раны от укола. Если питомец выглядит вялым, у него повышена температура и отсутствует аппетит, обратитесь за помощью к специалисту. Возможно, абсцесс придется удалять хирургическим путем или лечить приемом противовоспалительных препаратов;
- Температура у кота может быть сигналом того, что в организме происходит воспалительный процесс, или свидетельствовать об аллергической реакции на лекарственное средство. Закрывать глаза на это не следует: если температура держится в течение суток, необходимо показать кошку ветеринарному врачу.
 Если к повышению температуры присоединяется вялость, проблемы со стулом, рвота и другие симптомы, не характерные здоровому животному, в срочном порядке обратитесь к специалисту. Промедление может быть крайне опасным для здоровья питомца.
Если к повышению температуры присоединяется вялость, проблемы со стулом, рвота и другие симптомы, не характерные здоровому животному, в срочном порядке обратитесь к специалисту. Промедление может быть крайне опасным для здоровья питомца.
Выводы
Советуем не рисковать и доверять лечение питомца только специалистам. Малейшие ошибки при выполнении процедуры могут привести к серьезным осложнениям и потребуют длительного лечения.
- анатомия и физиология
- вакцинация
- заболевания
- руководство
Вам также будет интересно
Блохи у кошки: как вывести и защитить питомца
Нормы кормления кошек сухим кормом
Запор у кошек
Трава для кошек: почему кошки едят траву и какую давать
Как фотографировать кошек: фотосессия
О чем говорит положение ушей кошки
Как и почему мурлычет кошка?
Как приучить кошку или котенка к новому месту
Кастрированный кот метит: причины и что делать
Шерсть кошки
Особенности распорядка дня кошек
Кот кашляет и хрипит: причины и что делать хозяину
Назад к просмотру всех статей
Инъекционные методики
Комментариев к записи Методы инъекцийОпубликовано в рубрике кошка, Уход за домашними животными Автор PraveenОпубликовано
Инъекционное введение лекарства часто называют парентеральным путем (это означает, что лекарство не попадает в организм через кишечник). Эффективное лекарственное введение является ключевой частью большинства ветеринарных процедур, и многие лекарства наиболее эффективны при введении в виде инъекций. Введение лекарств путем инъекций необходимо для некоторых лекарств, которые разрушаются кислотами в желудке, например инсулина.
Эффективное лекарственное введение является ключевой частью большинства ветеринарных процедур, и многие лекарства наиболее эффективны при введении в виде инъекций. Введение лекарств путем инъекций необходимо для некоторых лекарств, которые разрушаются кислотами в желудке, например инсулина.
Общая информация
Инъекции можно делать в:
- мышцу (внутримышечно)
- ткань под кожей (подкожная)
- циркуляция (внутривенная)
- кожный (внутрикожный)
- Полости тела (брюшная, т.е. внутрибрюшинная, или грудная, т.е. внутриплевральная)
В этом Информационном бюллетене рассматриваются только внутримышечный и подкожный пути введения, так как именно с ними чаще всего сталкиваются владельцы кошек.
При проведении инъекций всегда следует применять асептические методы. Если шерсть очень грязная, ее следует подстричь и почистить. Кожу следует протереть спиртом. Никогда не вводите инъекцию через грязную или инфицированную кожу.
Различные лекарственные формы для инъекций используются для разных путей, и особенно важно не вводить инъекцию непосредственно в кровь, если это специально не рекомендовано для этого пути.
Подкожная инъекция
Этот путь используется для большинства инъекций и прививок. У домашних животных много дряблой кожи, поэтому очень просто приподнять кожный лоскут и ввести иглу в подкожную клетчатку. Под кожей находится несколько важных (или легко повреждаемых) структур, поэтому это очень безопасный способ введения лекарств, и владельцев можно легко научить делать инъекции таким образом. Владельцев животных с диабетом учат, как вводить инсулин подкожно, чтобы они могли делать регулярные инъекции своему питомцу дома. Этот путь не подходит для введения раздражающих препаратов, так как они могут вызвать некроз кожи и шелушение.
Внутримышечная инъекция
Препараты, вводимые в мышцы, всасываются очень быстро, поскольку эта область хорошо кровоснабжается. Инъекция в мышечную ткань сопряжена с риском, поскольку через мышечную ткань проходит много важных структур, например артерий, вен и нервов. Перед инъекцией важно убедиться, что игла случайно не попала в кровеносный сосуд (особенно в артерию) в мышце. После введения иглы в мышцу необходимо осторожно отсосать шприц, чтобы кровь не попала обратно в иглу.
Инъекция в мышечную ткань сопряжена с риском, поскольку через мышечную ткань проходит много важных структур, например артерий, вен и нервов. Перед инъекцией важно убедиться, что игла случайно не попала в кровеносный сосуд (особенно в артерию) в мышце. После введения иглы в мышцу необходимо осторожно отсосать шприц, чтобы кровь не попала обратно в иглу.
Одним из недостатков введения препарата глубоко в мышечную ткань является то, что трудно понять, что происходит в месте инъекции после того, как инъекция была сделана. Травматическая техника может привести к образованию синяков, а у животных с нарушениями свертываемости крови (например, при отравлении антикоагулянтами-родентицидами) кровотечение после внутримышечной инъекции может быть сильным. Однако, поскольку место инъекции скрыто, эти осложнения могут оставаться незамеченными в течение нескольких часов или дней.
Подходящими местами для внутримышечных инъекций являются четырехглавая мышца (на передней поверхности бедра), пояснично-дорсальные мышцы (по обе стороны от остистых отростков поясничных позвонков) или трехглавая мышца (позади плечевой кости передней ноги). Подколенные сухожилия (в задней части бедра) следует избегать из-за возможности повреждения седалищного нерва. Объемы инъекций у кошек не должны превышать 2 мл. Положительное действие при введении игл в мышцы уменьшает повреждение мышц и боль, а массирование места инъекции после инъекции рассеивает инъекцию и может помочь уменьшить боль.
Подколенные сухожилия (в задней части бедра) следует избегать из-за возможности повреждения седалищного нерва. Объемы инъекций у кошек не должны превышать 2 мл. Положительное действие при введении игл в мышцы уменьшает повреждение мышц и боль, а массирование места инъекции после инъекции рассеивает инъекцию и может помочь уменьшить боль.
Некоторые лекарства специально разработаны таким образом, что они медленнее всасываются и могут задерживаться в мышцах, постепенно всасываясь в течение многих месяцев (так называемые «депо-инъекции»).
Альтернативные пути введения лекарств
Дыхательные пути
Оболочка дыхательных путей тонкая и сосудистая, поэтому всасывание некоторых лекарств из этого места может быть очень быстрым. Интраназальные вакцины, например, от питомникового кашля, вводятся в нос, и живой вирус способен проникать через слизистую оболочку носа. Распыляемые лекарственные средства могут использоваться для лечения респираторных заболеваний, и введение таким путем позволяет быстро проникнуть в местный участок, где они должны оказывать свое действие. Однако использование небулайзеров означает, что пациент должен дышать воздухом, содержащим лекарство. Распыляемые лекарства можно вводить через лицевую маску, хотя многие пациенты в сознании не переносят лицевую маску, поэтому часто требуется специальная камера для распыления. При остановке сердца адреналин иногда вводят через эндотрахеальную трубку, и всасывание этим путем происходит быстро, и этот метод намного безопаснее, чем альтернативная внутрисердечная инъекция адреналина.
Однако использование небулайзеров означает, что пациент должен дышать воздухом, содержащим лекарство. Распыляемые лекарства можно вводить через лицевую маску, хотя многие пациенты в сознании не переносят лицевую маску, поэтому часто требуется специальная камера для распыления. При остановке сердца адреналин иногда вводят через эндотрахеальную трубку, и всасывание этим путем происходит быстро, и этот метод намного безопаснее, чем альтернативная внутрисердечная инъекция адреналина.
Внутрипаренхиматозное кровоизлияние в ствол головного мозга, вторичное по отношению к ятрогенной травме иглой после парентеральной инъекции у кошки
JFMS Open Rep. 2016 Jan-Jun; 2(1): 2055116916631562.
Опубликовано в сети 8 февраля 2016 г. doi: 10.1177/2055116916631562
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности острое начало неходячий правосторонний гемипарез и горизонтальный нистагм после попытки инъекции в шею, во время которой кошка не сотрудничала. Магнитно-резонансная томография (МРТ) выявила четко очерченное интрааксиальное поражение в правой части продолговатого мозга. Очаг был гипоинтенсивным по Т2-взвешенному и от гипоинтенсивного по Т1-взвешенному до изоинтенсивного по отношению к серому веществу, неконтрастным, с отеком вокруг очага и отсутствием сигнала на Т2*-взвешенных изображениях. Также наблюдалось линейное гиперинтенсивное поражение мышц правой дорсолатеральной части шеи на коротких изображениях восстановления инверсии тау. Эти результаты МРТ соответствовали ятрогенным кровоизлияниям в ствол головного мозга и мышечным иглам. Через 6 недель после травмы кошка хорошо поправилась с легким остаточным неврологическим дефицитом.
Магнитно-резонансная томография (МРТ) выявила четко очерченное интрааксиальное поражение в правой части продолговатого мозга. Очаг был гипоинтенсивным по Т2-взвешенному и от гипоинтенсивного по Т1-взвешенному до изоинтенсивного по отношению к серому веществу, неконтрастным, с отеком вокруг очага и отсутствием сигнала на Т2*-взвешенных изображениях. Также наблюдалось линейное гиперинтенсивное поражение мышц правой дорсолатеральной части шеи на коротких изображениях восстановления инверсии тау. Эти результаты МРТ соответствовали ятрогенным кровоизлияниям в ствол головного мозга и мышечным иглам. Через 6 недель после травмы кошка хорошо поправилась с легким остаточным неврологическим дефицитом.
Актуальность и новая информация
Насколько нам известно, это первое сообщение о ятрогенном повреждении ствола мозга иглой у кошки и первое сообщение о ятрогенной травме центральной нервной системы после парентеральной инъекции. Следует соблюдать осторожность при парентеральных инъекциях в шею, особенно в краниальную шейную область.
Подкожные и внутримышечные (ВМ) инъекции являются распространенными путями введения препарата, а местами для в/м инъекций рекомендуются четырехглавая, пояснично-спинная, трапециевидная и трехглавая мышцы. 1 Неправильное введение может привести к таким осложнениям, как повреждение седалищного нерва, о котором сообщалось после внутримышечной инъекции в подколенное сухожилие и ягодичные мышцы. 2,3 В этой статье описывается необычное и тяжелое осложнение у кошки после парентеральной инъекции в краниальную шейную область и показано, почему важно соблюдать осторожность даже при выполнении минимально инвазивных процедур.
6-месячная домашняя короткошерстная кошка была доставлена в ветеринарную клинику для стерилизации. После попытки провести парентеральную премедикацию медетомидином и буторфанолом в области шеи некомплаентной кошки с помощью шприца с иглой 23 G × 16 мм кошка потеряла сознание, мгновенно перестала передвигаться и была направлена. Сообщалось, что премедикация не вводилась, так как в шприце оставался тот же объем после попытки инъекции.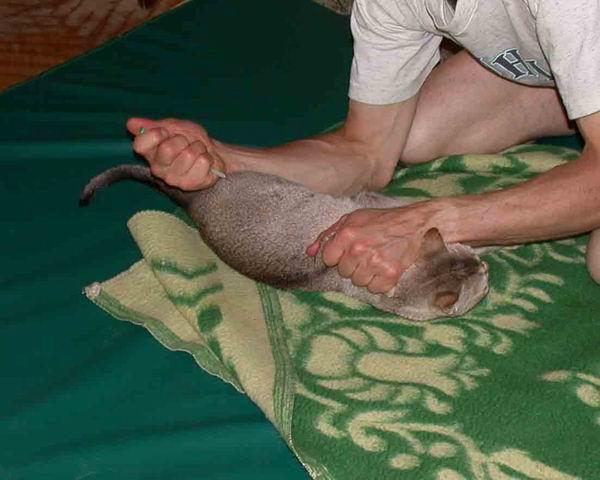 Ранее сообщалось, что кошка была здорова. Прививки и антигельминтный статус были текущими, кошка содержалась строго в помещении.
Ранее сообщалось, что кошка была здорова. Прививки и антигельминтный статус были текущими, кошка содержалась строго в помещении.
При направлении к врачу физикальное обследование не выявило каких-либо существенных изменений, кроме небольшого эритематозного поражения кожи в месте инъекции в правой краниальной шейной области. При неврологическом осмотре выявлено легкое притупление сознания с периодическим горизонтальным нистагмом, сниженная двусторонняя реакция на назальную стимуляцию и птоз правого верхнего века. У кошки был неамбулаторный правосторонний гемипарез. Замена лап, прыжковая, тактильная и зрительная постановка на правые грудные и тазовые конечности отсутствовали. Тонус мышц левой грудной и тазовой конечностей повышен, рефлекс отдергивания правой грудной конечности снижен. Рефлекс кожных мышц туловища (CTR) отсутствовал. Болевых ощущений при пальпации позвоночника или при пассивном сгибании головы и шеи не было.
На основании неврологических данных многоочаговая нейроанатомическая локализация с поражением ствола головного мозга (вестибулярные ядра, вестибулоспинальный тракт, симпатическая иннервация глаза, восходящая ретикулярная активирующая система и проприоцептивные пути) и сегментов спинного мозга C6–T2 или подозревалось единичное поражение ствола головного мозга со спинальным шоком. CTR может отсутствовать у неврологически нормальных кошек. 4 Реакция на стимуляцию слизистой оболочки носа представляет собой корково-опосредованное отдергивание головы и считается отсутствующим в результате нарушения восходящей ретикулярной активирующей системы. Основные дифференциальные диагнозы включали травматическое ятрогенное поражение, сосудистую аварию или воспалительное заболевание.
CTR может отсутствовать у неврологически нормальных кошек. 4 Реакция на стимуляцию слизистой оболочки носа представляет собой корково-опосредованное отдергивание головы и считается отсутствующим в результате нарушения восходящей ретикулярной активирующей системы. Основные дифференциальные диагнозы включали травматическое ятрогенное поражение, сосудистую аварию или воспалительное заболевание.
Общий анализ крови и биохимия сыворотки без особенностей. Протромбиновое и тромбопластиновое время в норме. Серийные измерения артериального давления были в пределах нормы. Динамическое рентгенологическое исследование (согнутая и расширенная проекции) шейного отдела позвоночника, выполненное под общей анестезией, не выявило патологии.
Магнитно-резонансная томография (МРТ) шейного отдела позвоночника и головного мозга выполнялась на аппарате 1,5 Тесла (Siemens Magnetom Essenza; Siemens). В правой вентро-латеральной части продолговатого мозга было идентифицировано четко очерченное округлое интрааксиальное поражение диаметром 2,5 мм. Поражение было гипоинтенсивным на Т2-взвешенных изображениях (T2W) и изо-гипоинтенсивным на Т1-взвешенных изображениях (T1W) по сравнению с нормальным серым веществом. На Т2*-взвешенных изображениях была идентифицирована округлая сигнальная пустота, соответствующая описанному выше поражению. Также наблюдалась гиперинтенсивность вокруг очага поражения на изображениях T2W и инверсионного восстановления с ослаблением жидкости (и ). После внутривенного введения гадолиния (0,1 ммоль/кг, Гадовист; Байер) контрастного усиления не наблюдалось. В мышцах правой дорсолатеральной части шеи на уровне С1-С2 на парасагиттальных изображениях восстановления с короткой инверсией тау-белка в направлении цистерны мозжечково-мозжечкового (CMC) наблюдалось линейное гиперинтенсивное поражение от каудодорсального до краниовентрального направления (рис. 1). Приведенное выше описание соответствовало геморрагическому поражению ствола головного мозга, связанному с отеком вокруг очага поражения. Изменения, наблюдаемые в мускулатуре шеи, были совместимы с следом от иглы.
Поражение было гипоинтенсивным на Т2-взвешенных изображениях (T2W) и изо-гипоинтенсивным на Т1-взвешенных изображениях (T1W) по сравнению с нормальным серым веществом. На Т2*-взвешенных изображениях была идентифицирована округлая сигнальная пустота, соответствующая описанному выше поражению. Также наблюдалась гиперинтенсивность вокруг очага поражения на изображениях T2W и инверсионного восстановления с ослаблением жидкости (и ). После внутривенного введения гадолиния (0,1 ммоль/кг, Гадовист; Байер) контрастного усиления не наблюдалось. В мышцах правой дорсолатеральной части шеи на уровне С1-С2 на парасагиттальных изображениях восстановления с короткой инверсией тау-белка в направлении цистерны мозжечково-мозжечкового (CMC) наблюдалось линейное гиперинтенсивное поражение от каудодорсального до краниовентрального направления (рис. 1). Приведенное выше описание соответствовало геморрагическому поражению ствола головного мозга, связанному с отеком вокруг очага поражения. Изменения, наблюдаемые в мускулатуре шеи, были совместимы с следом от иглы. Сбор спинномозговой жидкости (ЦСЖ) не предпринимался.
Сбор спинномозговой жидкости (ЦСЖ) не предпринимался.
Открыть в отдельном окне
Поперечные магнитно-резонансные изображения головы 6-месячной самки домашней короткошерстной кошки на уровне продолговатого мозга, иллюстрирующие четко очерченное поражение, гипоинтенсивное на (а) Т2-взвешенных и от изо- до гипоинтенсивного на (b) Т1-взвешенных изображениях, с сигнальной пустотой на (с) Т2*-взвешенных изображениях и гиперинтенсивностью вокруг края поражения на (а) Т2-взвешенных изображениях и (d) ослабленных жидкостью инверсионно-восстановительных изображениях (стрелки)
Открыть в отдельном окне
Сагиттальные магнитно-резонансные изображения головы и шеи 6-месячной домашней короткошерстной кошки, иллюстрирующие гипоинтенсивное поражение, окруженное гиперинтенсивным ободком перилезиона, на Т2-взвешенных изображениях (а, белая стрелка). В парасагиттальной проекции наблюдалось каудодорсальное к краниовентральному линейное гиперинтенсивное поражение в мышцах дорсолатеральной части шеи и в направлении цистерны мозжечково-мозжечкового на коротких изображениях восстановления инверсии тау (b, белый узкий)
Единственное лечение состояло из инфузионной терапии и трех последовательных противовоспалительных доз дексаметазона для уменьшения отека вокруг поражений (0,1 мг/кг внутривенно каждые 24 часа, Дексадрезон; Intervet). Клинические признаки постепенно улучшились во время госпитализации, и кошка восстановила способность ходить, но к 4-му дню оставалась гемипаретичной и атактической. Во время выздоровления наблюдалась периодическая широкая опорная стойка. На момент выписки, на 7-й день, у кошки сохранялся амбулаторный гемипарез, но улучшились постуральные реакции, нормализовались рефлексы отдергивания и исследование черепных нервов. Кошка была повторно осмотрена через полтора месяца после постановки диагноза. Единственными наблюдаемыми отклонениями были умеренный остаточный правосторонний гемипарез с умеренным снижением правосторонней постуральной реакции. Владелец сообщил, что кошка могла нормально прыгать на мебель, и наблюдалось постепенное улучшение.
Клинические признаки постепенно улучшились во время госпитализации, и кошка восстановила способность ходить, но к 4-му дню оставалась гемипаретичной и атактической. Во время выздоровления наблюдалась периодическая широкая опорная стойка. На момент выписки, на 7-й день, у кошки сохранялся амбулаторный гемипарез, но улучшились постуральные реакции, нормализовались рефлексы отдергивания и исследование черепных нервов. Кошка была повторно осмотрена через полтора месяца после постановки диагноза. Единственными наблюдаемыми отклонениями были умеренный остаточный правосторонний гемипарез с умеренным снижением правосторонней постуральной реакции. Владелец сообщил, что кошка могла нормально прыгать на мебель, и наблюдалось постепенное улучшение.
Насколько нам известно, это первое сообщение о ятрогенном повреждении ствола мозга иглой у кошки и первое сообщение о ятрогенной травме центральной нервной системы (ЦНС) после парентеральной инъекции. Ранее сообщалось о ятрогенных повреждениях ЦНС после попыток сбора спинномозговой жидкости из ЦКМ и каудально-поясничного отдела у собак, а также после имплантации микрочипа у собак и кошек. 5–8 У человека было описано укол иглой и инфаркт спинного мозга. 9 В данном случае мы подозреваем, что игла попала в ЦНС через атланто-затылочное соединение. Линейное гиперинтенсивное поражение мышц дорсальной поверхности шеи от каудодорсального до краниовентрального направления в направлении ЦМЦ подтверждает эту теорию.
5–8 У человека было описано укол иглой и инфаркт спинного мозга. 9 В данном случае мы подозреваем, что игла попала в ЦНС через атланто-затылочное соединение. Линейное гиперинтенсивное поражение мышц дорсальной поверхности шеи от каудодорсального до краниовентрального направления в направлении ЦМЦ подтверждает эту теорию.
При оценке результатов четырех собак с ятрогенным повреждением ствола мозга, описанным в вышеуказанной литературе, одна собака умерла от остановки дыхания, две были подвергнуты эвтаназии из-за неопределенности выздоровления и внезапного ухудшения состояния через 12 дней после постановки диагноза, а одна собака была потеряна для последующего наблюдения. через 10 дней госпитализации и восстановления произвольного мочеиспускания и передвижения с помощью. 5 В целом исход в этой небольшой группе случаев плохой. Мы сообщаем о хорошем результате у этой кошки.
Сигнал МРТ для внутричерепного кровоизлияния хорошо задокументирован. 10,11 Его внешний вид зависит от продолжительности и изменений гемоглобина крови. Кошка была визуализирована менее чем через 8 часов после травматического повреждения. При острейших (<24 ч) поражениях в паренхиматозных гематомах ожидается гиперинтенсивный сигнал T2W и изо- или гипоинтенсивный сигнал T1W. 11 Быстрая визуализация у этой кошки могла повлиять на отсутствие сигнала гиперинтенсивного поражения T2W, но отсутствие сигнала, наблюдаемое на T2*-взвешенных изображениях, подтверждает его наличие. Имелись признаки цитотоксического и/или вазогенного отека вокруг предполагаемой гематомы. Аналогичные результаты были зарегистрированы у собак с гематомиелией после люмбальной пункции. 6 Отсутствие коагулопатии свидетельствует о ятрогенном происхождении.
10,11 Его внешний вид зависит от продолжительности и изменений гемоглобина крови. Кошка была визуализирована менее чем через 8 часов после травматического повреждения. При острейших (<24 ч) поражениях в паренхиматозных гематомах ожидается гиперинтенсивный сигнал T2W и изо- или гипоинтенсивный сигнал T1W. 11 Быстрая визуализация у этой кошки могла повлиять на отсутствие сигнала гиперинтенсивного поражения T2W, но отсутствие сигнала, наблюдаемое на T2*-взвешенных изображениях, подтверждает его наличие. Имелись признаки цитотоксического и/или вазогенного отека вокруг предполагаемой гематомы. Аналогичные результаты были зарегистрированы у собак с гематомиелией после люмбальной пункции. 6 Отсутствие коагулопатии свидетельствует о ятрогенном происхождении.
При отсутствии травмы спонтанное внутрипаренхиматозное кровоизлияние у человека является частой причиной внутричерепного кровоизлияния. Подавляющее большинство случаев первичных стволовых кровоизлияний приходится на мост и составляют 5–10% внутричерепных кровоизлияний. 12 Другие причины включают разрыв аневризмы, артериовенозные мальформации, кавернозную гемангиому, болезнь моямоя, васкулит, опухоли головного мозга и геморрагические инфаркты. 13 Объем гематомы ствола мозга коррелирует с выживаемостью и функциональным исходом. 13 Эффективность операции по удалению гематомы и наружному дренированию желудочков остается дискуссионной и требует дальнейших исследований. 14 В данном случае мы выбрали консервативное лечение из-за непрогрессирующего характера клинических признаков у кошки с самого начала.
12 Другие причины включают разрыв аневризмы, артериовенозные мальформации, кавернозную гемангиому, болезнь моямоя, васкулит, опухоли головного мозга и геморрагические инфаркты. 13 Объем гематомы ствола мозга коррелирует с выживаемостью и функциональным исходом. 13 Эффективность операции по удалению гематомы и наружному дренированию желудочков остается дискуссионной и требует дальнейших исследований. 14 В данном случае мы выбрали консервативное лечение из-за непрогрессирующего характера клинических признаков у кошки с самого начала.
Спинальный шок определяется как глубокая височная депрессия сегментарных спинальных рефлексов ниже (т.е. каудальнее) очага поражения, даже если рефлекторные дуги остаются физически интактными. 15,16 Он был вызван не только у собак после экспериментальных перерезок грудного отдела спинного мозга, 17,18 , но также был описан в клинических случаях с повреждением спинного мозга в сегментах T3–L3 спинного мозга. 19–21 Насколько нам известно, в ветеринарной литературе описана только одна собака с транзиторным снижением сегментарных спинномозговых рефлексов после острой шейной травмы спинного мозга; 20 однако, насколько нам известно, это явление не было описано ни у собак, ни у кошек после травмы ствола мозга. Считается, что спинальные рефлексы утрачены из-за утраты нисходящих стимулирующих входов от двух ядер, расположенных в мосту, а также серотонинергических и норадренергических волокон, исходящих из дорсального ядра шва и голубого пятна, что вызывает снижение возбудимости спинальных мотонейронов. 19,22 Поражение у этой кошки располагалось ниже уровня моста. Отсутствие поражения сегмента спинного мозга С6-Т2 и быстрое восстановление рефлекса отдергивания свидетельствовали о наличии спинального шока.
19–21 Насколько нам известно, в ветеринарной литературе описана только одна собака с транзиторным снижением сегментарных спинномозговых рефлексов после острой шейной травмы спинного мозга; 20 однако, насколько нам известно, это явление не было описано ни у собак, ни у кошек после травмы ствола мозга. Считается, что спинальные рефлексы утрачены из-за утраты нисходящих стимулирующих входов от двух ядер, расположенных в мосту, а также серотонинергических и норадренергических волокон, исходящих из дорсального ядра шва и голубого пятна, что вызывает снижение возбудимости спинальных мотонейронов. 19,22 Поражение у этой кошки располагалось ниже уровня моста. Отсутствие поражения сегмента спинного мозга С6-Т2 и быстрое восстановление рефлекса отдергивания свидетельствовали о наличии спинального шока.
Основным ограничением данного отчета о клиническом случае является отсутствие гистопатологического подтверждения. Тем не менее, острое начало после попытки парентеральной инъекции в шею, поражение кожи, ориентация предполагаемого пути мышечной иглы и результаты визуализации, сходные с ранее описанными ятрогенными травматическими повреждениями ствола мозга и поясничного отдела у собак, убедительно подтверждают наш предположительный диагноз. 5,6
5,6
Этот случай демонстрирует клинические и визуализационные проявления ятрогенного повреждения ствола мозга иглой у кошки. Это также показывает, что спинальный шок может возникать при миелэнцефальных повреждениях. Следует соблюдать осторожность при парентеральных инъекциях в шею маленьким собакам и кошкам, особенно в краниальную шейную область. Хотя в ветеринарной литературе недостаточно данных для правильной оценки исхода у собак и кошек после травматического повреждения ствола мозга иглой, настоящий случай предполагает, что хороший исход возможен у некоторых кошек только при поддерживающем лечении.
Конфликт интересов: Авторы заявили об отсутствии потенциального конфликта интересов в отношении исследования, авторства и/или публикации этой статьи.
Финансирование: Авторы не получали финансовой поддержки для исследования, авторства и/или публикации этой статьи.
1.
Орпет Х, Уэлш П.
Введение и отпуск лекарственных препаратов.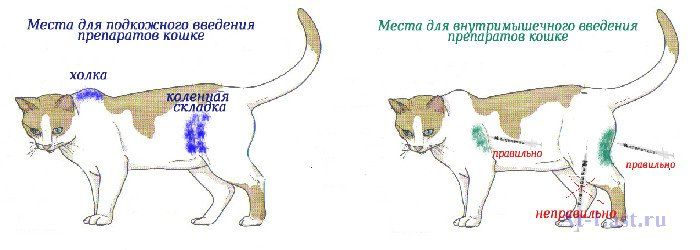 В: Orpet H, Welsh P. (ред.). Справочник ветеринарного врача. 1-е изд.
В: Orpet H, Welsh P. (ред.). Справочник ветеринарного врача. 1-е изд.
Оксфорд: Blackwell Science, 2002, стр. 63–64. [Академия Google]
2.
Фортерре Ф., Томек А., Ритц Ю. и др.
Ятрогенное повреждение седалищного нерва у восемнадцати собак и девяти кошек (1997–2006 гг.). Вет сург
2007 г.; 36: 464–471. [PubMed] [Google Scholar]
3.
Эванс Х.Э., де Лахунта А.
Позвоночные нервы. В: Эванс Х.Э., де Лахунта А. (ред.). Анатомия собаки Миллера. 4-е изд.
Сент-Луис, Миссури: WB Saunders, 2013, стр. 650–651. [Google Scholar]
4.
де Лахунта А., Гласс Э., Кент М.
Нижний мотонейрон: спинномозговой нерв, общая соматическая эфферентная система. В: де Лахунта А., Гласс Э., Кент М. (ред.). Ветеринарная нейроанатомия и клиническая неврология. 4-е изд.
Сент-Луис, Миссури: WB Saunders, 2015, стр. 110–111. [Академия Google]
5.
Лухан Фелиу-Паскуаль А., Гарози Л., Деннис Р. и др.
Ятрогенное повреждение ствола головного мозга при пункции мозжечково-медуллярных цистерн. Ветеринар Радиол Ультразвук
2008 г.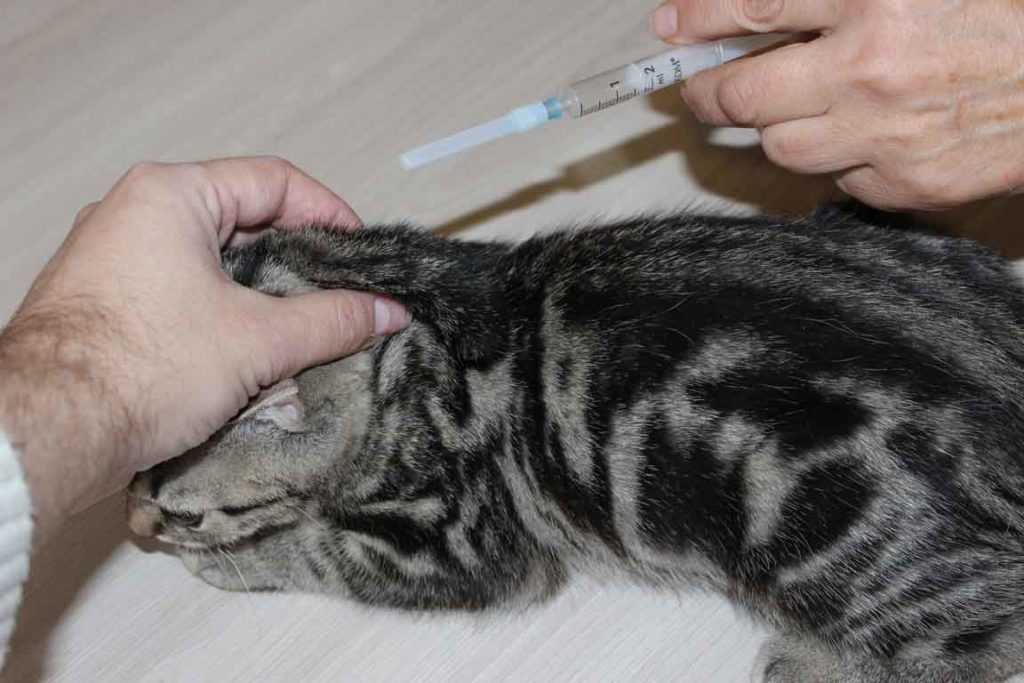 ; 49: 467–471. [PubMed] [Google Scholar]
; 49: 467–471. [PubMed] [Google Scholar]
6.
Платт С.Р., Деннис Р., Мерфи К. и др.
Гематомиелия, вторичная по отношению к люмбальному попаданию спинномозговой жидкости у собаки. Ветеринар Радиол Ультразвук
2005 г.; 46: 467–471. [PubMed] [Google Scholar]
7.
Смит Т.Дж., Фитцпатрик Н.
Хирургическое удаление микрочипа из позвоночного канала щенка. Вет Комп Ортоп Трауматол
2009 г.; 22: 63–65. [PubMed] [Google Scholar]
8.
Платт С., Вечорек Л., Деннис Р. и др.
Травма спинного мозга в результате неправильного размещения микрочипа у кошки. J Feline Med Surg
2007 г.; 9: 157–160. [PubMed] [Google Scholar]
9.
Джозеф Г., Сантош С., Маримуту Р. и др.
Инфаркт спинного мозга из-за укола иглой. Спинной мозг
2004 г.; 42: 655–658. [PubMed] [Google Scholar]
10.
Вайнгартен К., Циммерман Р.Д., Део-Нарине В. и др.
МРТ острого внутричерепного кровоизлияния: результаты последовательных спин-эхо и градиент-эхо на модели собаки. Am J Нейрорадиол
1991; 12: 457–467. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11.
Бэгли Р.С., Гэвин П.Р., Холмс С.П.
Диагностика внутричерепных заболеваний. В: Бэгли Р.С., Гэвин П.Р. (ред.). Практическая МРТ мелких животных. 1-е изд.
Эймс, ИА: Wiley-Blackwell, 2009, стр. 95–102. [Google Scholar]
12.
Динсдейл ХБ.
Спонтанное кровоизлияние в заднюю черепную ямку. Изучение первичных мозжечковых и мостовых кровоизлияний с наблюдением за их патогенезом. Арка Нейрол
1964 год; 10: 200–217. [PubMed] [Академия Google]
13.
Такеучи С., Судзуки Г., Такасато Ю. и др.
Прогностические факторы у больных с первичным кровоизлиянием в ствол головного мозга. Клин Нейрол Нейрохирург
2013; 115: 732–735. [PubMed] [Google Scholar]
14.
Хара Т., Нагата К., Кавамото С. и др.
Функциональный исход первичного кровотечения в мосту: консервативное лечение или стереотаксическая операция. Но Синкей Гека
2001 г.; 29: 823–829. [PubMed] [Google Scholar]
15.
де Лахунта А., Гласс Э., Кент М.
Болезнь спинного мозга мелких животных. В: де Лахунта А., Гласс Э., Кент М. (ред. ). Ветеринарная нейроанатомия и клиническая неврология. 4-е изд.
). Ветеринарная нейроанатомия и клиническая неврология. 4-е изд.
Сент-Луис, Миссури: WB Saunders, 2015, стр. 262–263. [Академия Google]
16.
Лейс А.А., Кроненберг М.Ф., Стэткарова И. и соавт.
Возбудимость спинного мотонейрона после острой травмы спинного мозга у человека. неврология
1996 год; 47: 231–237. [PubMed] [Google Scholar]
17.
Ханда Ю., Найто А., Ватанабэ С. и др.
Функциональное восстановление локомотивного поведения у взрослой позвоночной собаки. Тохоку Джей Опыт Мед
1986 год; 148: 373–384. [PubMed] [Google Scholar]
18.
Блаух Б.
Спинномозговой рефлекс при ходьбе у собаки. Vet Med Small Anim Clin
1977 год; 72: 169–173. [PubMed] [Академия Google]
19.
Смит П.М., Джеффри Н.Д.
Сравнительные аспекты спинального шока и клиническая значимость. Джей Вет Стажер Мед
2005 г.; 19: 788–793. [PubMed] [Google Scholar]
20.
Белтран Э., Деннис Р., Дойл В. и др.
Клинические и магнитно-резонансные изображения компрессионной цервикальной миелопатии у собак с подозрением на экструзию гидратированного студенистого ядра.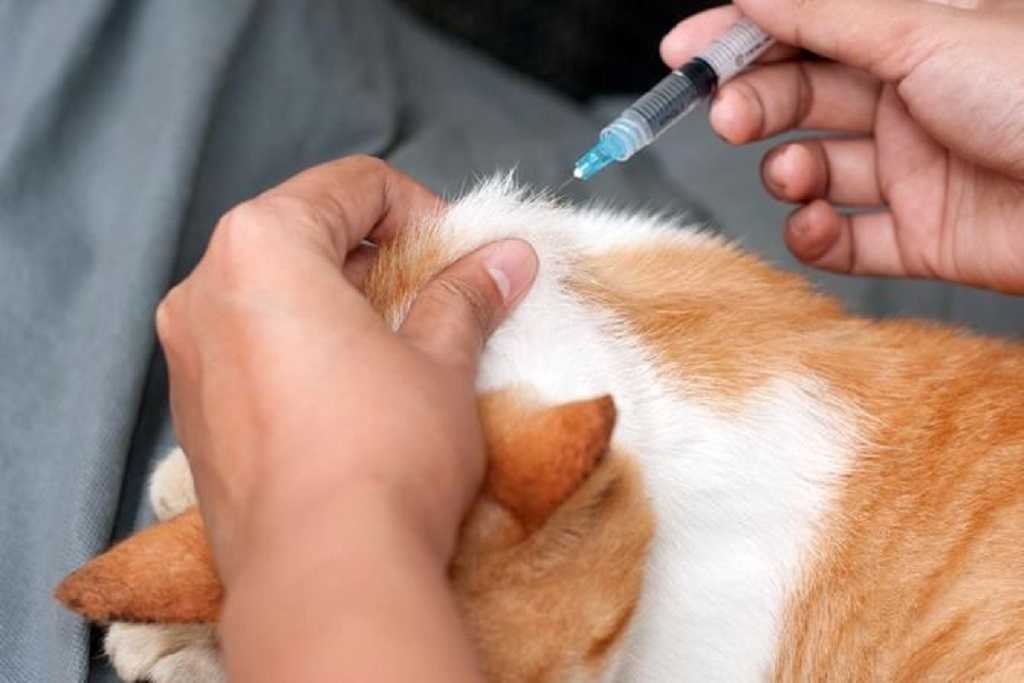

 Помещенная на холку прищепка, будет создавать у животного чувство, что его держат и не станет сдвигаться с места.
Помещенная на холку прищепка, будет создавать у животного чувство, что его держат и не станет сдвигаться с места.
 Пилочка, как правило, идет в комплекте;
Пилочка, как правило, идет в комплекте; Не касайтесь стерильной иглы руками;
Не касайтесь стерильной иглы руками; Следите, чтобы игла не проткнула кожу насквозь;
Следите, чтобы игла не проткнула кожу насквозь;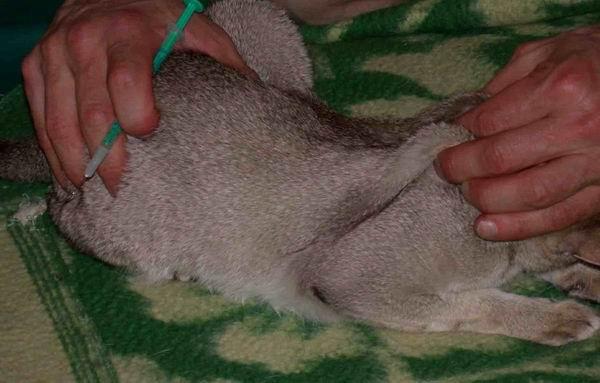 Чтобы правильно определить место укола, найдите бедренную кость и отступите расстояние, равное длине большого пальца;
Чтобы правильно определить место укола, найдите бедренную кость и отступите расстояние, равное длине большого пальца; Появление уплотнений свидетельствует о том, что препарат не рассосался или что рана от укола не заживает. Шишки, как правило, появляются от введения препаратов на масляной основе или больших объемов лекарственного средства. Наблюдайте за питомцем в течение 1-2 дней: если уплотнение не рассасывается, питомца необходимо показать специалисту;
Появление уплотнений свидетельствует о том, что препарат не рассосался или что рана от укола не заживает. Шишки, как правило, появляются от введения препаратов на масляной основе или больших объемов лекарственного средства. Наблюдайте за питомцем в течение 1-2 дней: если уплотнение не рассасывается, питомца необходимо показать специалисту; Если к повышению температуры присоединяется вялость, проблемы со стулом, рвота и другие симптомы, не характерные здоровому животному, в срочном порядке обратитесь к специалисту. Промедление может быть крайне опасным для здоровья питомца.
Если к повышению температуры присоединяется вялость, проблемы со стулом, рвота и другие симптомы, не характерные здоровому животному, в срочном порядке обратитесь к специалисту. Промедление может быть крайне опасным для здоровья питомца.